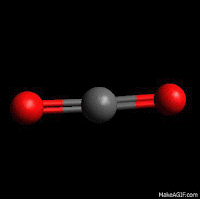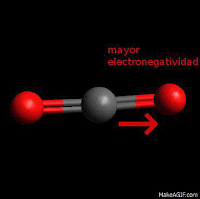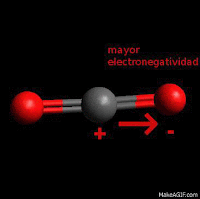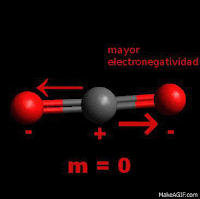
Hidrocarburos
Son compuestos constituidos exclusivamente por
carbono e hidrógeno.
Pueden ser:
a) ACICLICOS:
Son hidrocarburos de cadenas carbonadas abiertas. Existen dos tipos de
cadenas abiertas:
-Cadenas lineales: Los átomos de carbono
pueden escribirse en línea recta.
Ejemplo:
-Cadenas ramificadas: Están constituidas por dos o más cadenas lineales enlazadas. La
cadena lineal más importante se denomina cadena principal; las cadenas que se
enlazan con ella se llaman radicales.
Ejemplo:
b) CÍCLICOS: Son
hidrocarburos de cadenas carbonadas cerradas, formadas al unirse dos átomos
terminales de una cadena lineal. Las cadenas carbonadas cerradas reciben el
nombre de ciclos.
Ejemplo:
Existen hidrocarburos policíclicos,
constituidos por varios ciclos unidos entre sí.
Ejemplo:
Hidrocarburos saturados, parafinas o alcanos
Se llaman hidrocarburos saturados o alcanos los
compuestos constituidos por carbono e hidrógeno, que son de cadena abierta y
tienen enlaces simples.
Alcanos de cadena lineal
Su fórmula empírica es CnH2n+2, siendo n el
número de átomos de carbono.
Los alcanos de cadena lineal forman series
homólogas, conjuntos de compuestos con propiedades químicas similares y
que difieren en el número de átomos de carbono de la cadena. Ejemplo:
Hidrocarburos Con Dobles Enlaces, Olefinas o Alquenos
Son hidrocarburos que presentan uno o más dobles
enlaces entre los átomos de carbono. La fórmula general, para compuestos con un
solo doble enlace, es CnH2n. Siendo N el número de carbonos presentes en la
molécula del compuesto.
-Alquenos con un solo doble enlace
Se nombran según las siguientes normas:
• Se elige la cadena más larga que contiene al
doble enlace y se sustituye la terminación ano por eno.
• Se numera la cadena a partir del extremo más
próximo al doble enlace. El localizador de éste es el menor de los dos números
que corresponden a los dos átomos de carbono unidos por el doble enlace.
• La posición del doble enlace o instauración se
indica mediante el localizador correspondiente que se coloca delante del
nombre.
• Si hay radicales, se toma como cadena
principal la cadena más larga de las que contienen el doble enlace. La
numeración se realiza de tal modo que al átomo de carbono con doble enlace le
corresponda el localizador más bajo posible. Los radicales se nombran como en
los alcanos. Ejemplos:
-Alquenos con varios dobles enlaces
• Cuando un hidrocarburo contiene más de un
doble enlace, se utilizan para nombrarlo las terminaciones: -adieno, -atrieno,
etc., en lugar de la terminación eno*. Se numera la cadena asignando a los
carbonos con doble enlace los localizadores más bajos que se pueda.
Ejemplo:
-Radicales univalentes derivados de los
alquenos lineales
Se obtienen a partir de los alquenos por pérdida
de un átomo de hidrógeno de un átomo de carbono terminal. En la numeración del
radical, el carbono con la valencia libre (por pérdida del átomo de hidrógeno)
recibe el número 1. Se nombran anteponiendo el prefijo numeral correspondiente
a la terminación enilo. Ejemplos:
Hidrocarburos con triples enlaces, acetilenos o alquinos
Son hidrocarburos que presentan uno o más
triples enlaces entre los átomos de carbono. La fórmula general, para
compuestos con un sólo triple enlace, es CnH2n-2. N indica el número de
carbonos presentes en la molécula del compuesto. Aplicando la fórmula general:
N=2------C2H2(2)-2= C2H2
N=5------C5H2(5)-2=C5H8
-Alquinos con un solo
triple enlace
Se nombran de acuerdo con las siguientes normas:
• Se elige la cadena más larga del hidrocarburo
que contiene el triple enlace y se coloca la terminación ino.
• Se numera la cadena a partir el extremo más
próximo al triple enlace.
• La posición de éste se indica mediante el
localizador correspondiente, que será el menor de los dos números asignados a
los dos átomos de carbono unidos por el triple enlace. El localizador se coloca
delante del nombre. Ejemplo:
• Si hay radicales, se toma como cadena
principal la cadena más larga que contenga el triple enlace. La numeración se
realiza de modo que corresponda al átomo de carbono con triple enlace el
localizador más bajo posible. Los radicales se nombran como en los alcanos.
Ejemplos:
- Alquinos con varios triples enlaces
• Si en un compuesto existen dos o más triples
enlaces, se utilizan para nombrarlo las terminaciones -adiino, -atriino, etc.,
en lugar de la terminación ino*. Se numera la cadena asignando a los carbonos
con triple enlace los localizadores más bajos que se pueda.
Ejemplo:
Si los radicales tienen dobles y triples
enlaces, se nombran primero los dobles enlaces, y luego los triples, señalando
su posición con localizadores. Se suprime la "o" de la terminación
eno. Ejemplos:
* Las verdaderas terminaciones son -diino, -triino,
etc. Se incluye en ellas la letra "a" para evitar nombres de fonética
desagradable.
Hidrocarburos cíclicos
Son hidrocarburos de cadenas carbonadas que se
cierran en sus extremos para formar ciclos de tres átomos o más. La presencia
de enlaces simples, dobles y triples en la cadena cerrada los clasifica en
cicloalcanos, cicloalquenos y cicloalquinos. En ocasión pueden presentar más de
un ciclo y se les llama Policíclicos. Según tengan o no instauraciones, se
clasifican en:
• Hidrocarburos monocíclicos saturados
(cicloalcanos).
• Hidrocarburos monocíclicos no saturados
(cicloalquenos y cicloalquinos).
- Hidrocarburos monocíclicos no saturados
Los átomos de carbono del hidrocarburo cíclico
que están unidos por enlaces sencillos. Responden a la fórmula general CnH2n.
Se nombran anteponiendo el prefijo ciclo al
nombre del alcano de cadena abierta de igual número de átomos de carbono.
- Radicales univalentes de los
cicloalcanos
Los radicales o grupos univalentes derivados de
los cicloalcanos por pérdida de un átomo de hidrógeno se nombran como en los
alcanos acíclicos, es decir, sustituyendo la terminación ano por ilo.
- Cicloalcanos con radicales
Los cicloalcanos sustituidos (que tienen
radicales unidos al ciclo) se nombran como derivados de los hidrocarburos
cíclicos. El ciclo se numera de tal modo que se asignen los localizadores más
bajos al conjunto de los radicales. En casos sencillos, se pueden nombrar como derivados
de un compuesto de cadena abierta. Ejemplos:
Hidrocarburos aromáticos
Son compuestos cíclicos que guardan estrecha
relación con el benceno (C6H6). Recibieron este nombre porque la gran mayoría
de ellos poseen olores fuertes y penetrantes. En la actualidad, el término
aromático expresa que el compuesto es más estable de lo esperado, es decir,
menos reactivo.
El nombre genérico de los hidrocarburos
aromáticos es areno y los radicales derivados de ellos se llaman arilo.
El benceno es la base de estos compuestos; su
fórmula se expresa de uno de estos tres modos:
• Los compuestos aromáticos que tienen
sustituyentes se nombran anteponiendo los nombres de los radicales a la palabra
benceno. Ejemplos:
• Cuando hay dos sustituyentes, su posición
relativa se indica mediante los números 1,2; 1,3 y 1,4 o mediante los prefijos
orto (o), meta (m) y para (p), respectivamente. Ejemplos:
• Si hay tres o más sustituyentes, se numera el
hidrocarburo de tal manera que estos radicales reciban los localizadores más
bajos en conjunto. Se citan en orden alfabético. Ejemplos:
- Otros hidrocarburos aromáticos importantes
Existen muchos hidrocarburos policíclicos
fusionados. Citaremos los tres más sencillos e importantes:
Derivados halogenados de los hidrocarburos
Son hidrocarburos que contienen en su molécula
átomos de halógeno.
Se nombran anteponiendo el nombre del halógeno
(fluoro, cloro, bromo, yodo) al del hidrocarburo correspondiente. La posición
de los átomos de halógeno se indica por medio de localizadores. Ejemplos:
Si existen dobles y triples enlaces, se numera
la cadena de modo que a las instauraciones les correspondan los localizadores
más pequeños. Al nombrar los derivados halogenados de cadena ramificada, los
halógenos se consideran como radicales y se citan en el lugar que les corresponde
según el orden alfabético. Ejemplos:
 El carbono tiene un número atómico de seis, lo que significa que tiene seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
El carbono tiene un número atómico de seis, lo que significa que tiene seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.